La
osteoporosis es una enfermedad cada día más frecuente en el niño,
debido al aumento del diagnóstico y tratamiento de enfermedades crónicas,
tanto genéticas como adquiridas. Se requiere un alto nivel de sospecha
para un diagnóstico precoz y manejo preventivo. Se revisan los conceptos
actuales en el enfrentamiento clínico, interpretación adecuada
de las herramientas de laboratorio bioquímico y radiológico, y
tratamientos específicos, reportando la experiencia local.
INTRODUCCIÓN
La osteoporosis es la alteración metabólica ósea más frecuente en el adulto; la densidad mineral ósea (DMO) en la edad adulta depende principalmente de la masa ósea máxima adquirida durante la etapa de adolescente y adulto joven. La disminución en la DMO se asocia a un aumento en el riesgo de fractura tanto en el adulto, como en el niño.
El pediatra juega un importante rol, tanto en la prevención, como en el diagnóstico precoz de esta patología emergente en la niñez, y que ha sido reconocida como una entidad especialmente secundaria a enfermedades crónicas.
El objetivo de esta revisión es reconocer los factores involucrados en el desarrollo de la osteoporosis en el niño, su diagnóstico, manejo y prevención, y presentar la experiencia en nuestro país.
Hueso y Metabolismo óseo en niños sanos
El hueso se compone de células, osteoblastos y osteoclastos, y una matriz orgánica y una mineral. El osteoblasto sintetiza la matriz proteica, la que está formada tanto por proteínas colágenas, como no colágenas, y se mineraliza por cristales de hidroxiapatita (fosfato de calcio).
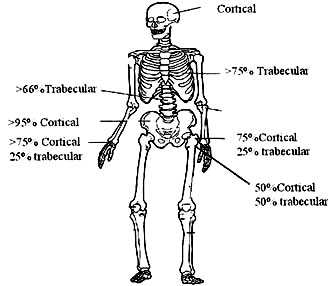
Es posible diferenciar 2 tipos de hueso en el esqueleto (figura 1): el hueso trabecular o hueso esponjoso que se encuentra principalmente en vértebras, metáfisis y calcáneo y el hueso cortical o hueso compacto que corresponde al 80% del total del esqueleto. El hueso trabecular presenta un mayor recambio metabólico que el hueso cortical, por lo que es más susceptible de ser afectado por enfermedades o medicamentos; su función es fundamentalmente metabólica participando en la homeostasis del calcio extracelular. El hueso cortical en cambio, se mide principalmente en cuello femoral y su función principal es mecánica y protectora.

Recambio, remodelación y metabolismo óseo
El hueso se encuentra en constante recambio; en este proceso participan los osteoclastos, responsables de la resorción ósea en la superficie del hueso y los osteoblastos, encargados de la formación. El control de la formación y resorción está mediado por factores mecánicos y no mecánicos. Para un correcto balance entre estos dos estados, se requiere de una adecuada homeostasis en el metabolismo del calcio y fósforo, en el que participan hormonas como Parathormona (PTH) y vitamina D (figura 2). El remodelamiento óseo es un proceso que involucra el crecimiento y el recambio óseo y ocurre principalmente en la superficie endosteal. En el desarrollo y crecimiento óseo del niño hay dos procesos involucrados: la osificación intramembranosa (huesos planos) y la osificación endocondral (metáfisis de huesos largos). El recambio óseo en niño es mayor que en el adulto, aproximadamente 10 veces mayor en un neonato y 6 veces mayor en el escolar. Por este motivo un niño puede perder y recuperar masa ósea más rápidamente que el adulto.
|
|
La ganancia de masa ósea, ocurre mayoritariamente durante los 2 primeros años de vida y en la pubertad, aumentando entre un 40 a 60% en este último período y declinando rápidamente 2 años posterior a la menarquia6,15. La acumulación de masa ósea se mantiene durante la adolescencia tardía y hasta la 3° o 4° década de la vida. A través de técnicas de cuantificación de DMO, se ha determinado que la masa ósea máxima se alcanza primero en el fémur (aproximadamente a los 16 años en la niña) y luego en la columnaa lumbar (aproximadamente a los 18 años), mientras que para radio, cráneo y cuerpo total, existe todavía un aumento mínimo sobre los 40 años. Se ha estimado que más del 80% en la variación en la DMO está genéticamente determinada, involucrándose múltiples genes (gen del receptor de vitamina D, gen del colágeno tipo I 1(COL1A1), entre otros)y un 20% correspondería a otros como factores hormonales, nutricionales, estilos de vida, actividad física, ingesta de calcio y peso corporal.
EVALUACIÓN DEL METABOLISMO ÓSEO
Marcadores de recambio óseo
Los marcadores de recambio óseo permiten evaluar las características metabólicas de la osteoporosis (alta resorción o baja formación) y evaluar la respuesta al tratamiento; debido a que en la edad pediátrica se producen cambios significativos principalmente durante la pubertad, es necesario interpretarlos de acuerdo a la edad, sexo y estado puberal. Debido al alto recambio óseo del niño, su utilidad ha mostrado ser superior a la reportada en adultos. Se dividen en marcadores de formación ósea y de resorción.
Marcadores de formación ósea
Fosfatasas Alcalinas (FA): El 80% de las FA derivan del hueso; el tipo específico óseo es producido por el osteoblasto y es el marcador más asequible de formación ósea.
Procolágeno Tipo I: El 90% de la matriz orgánica del hueso es colágeno tipo I. Fragmentos de procolágeno son liberados durante la formación de la matriz proteica.
Osteocalcina: proteína no colágena pequeña sintetizada por osteoblastos y condrocitos que se deposita en la matriz ósea extracelular. Una pequeña proporción entra a la circulación y es eliminada por el riñón.
Marcadores de resorción
N-telopéptido y C-telopéptido ligados al colágeno tipo I: son productos del colágeno tipo I, que se liberan durante la resorción. Pueden ser medidos en suero u orina.
Hidroxiprolina urinaria: es un aminoácido que se encuentra en proteínas del colágeno del hueso y de otros tejidos conectivos.
Deoxipiridinolina y Piridinolina: aminoácidos encontrados en colágeno de distintos tejidos. Se puede medir a través de cromatografía líquida de alta resolución y a través de la medición de la fracción libre (Pyrilink®-D).
Índice Calciuria/Creatininuria: es un marcador menos específico que los otros.
Métodos de evaluación de DMO
Existen 4 métodos para evaluar la densidad mineral ósea DMO:
SPA (Single photon absorptiometry): Menos precisa y reproducible que DEXA, por lo que se ha utilizado en estudios poblacionales, pero no es adecuada para el diagnóstico y seguimiento de osteoporosis.
DEXA (Dual energy x-ray absorptiometry): Permite medir la DMO en columna, fémur y otras regiones. Evalúa la relación entre cantidad de mineral medido y el área proyectada o densintometría “areal”. A través de la medición combinada en varios sitios se puede obtener información acerca de la densidad ósea en hueso cortical y trabecular, además permite estimar la composición corporal, masa magra, masa grasa y contenido mineral óseo total. A través de un modelo matemático es posible calcular la densidad volumétrica: vBMD (g/cm3) = CMO x Volumen óseo. En niños el lugar más usado es la columna lumbar30. Este cálculo sustrae significativamente el efecto del tamaño corporal sobre DMO, por lo que permite diagnosticar con menor error osteoporosis en niños con talla baja.
Tomografía computada cuantitativa: Permite obtener imágenes en 3 dimensiones y por tanto medir directamente la densidad volumétrica, además de separar el hueso trabecular del cortical. Sus desventajas son un alto costo y dosis de radiación significativas.
Ultrasonido: De escasa utilidad en el niño, ya que las zonas a evaluar se encuentran en constante cambio.
Osteoporosis en el niño
La definición de osteoporosis internacionalmente aceptada se refiere a “la enfermedad caracterizada por la disminución de la masa ósea y el deterioro de la microarquitectura del tejido óseo, que lleva a un aumento en la fragilidad ósea con el consecuente riesgo de fractura”. Se considera a la DMO como uno de los mejores predictores del riesgo de fractura.
La osteoporosis ha sido definida en el adulto como un puntaje T < -2,5 y osteopenia ¾1, basado en estudios epidemiológicos longitudinales que asocian los valores densitométricos y el riesgo de fractura1,6. En niños no existen estudios de este tipo, por lo que no disponemos de un consenso en el diagnóstico de osteoporosis. Sí, esta claro que cualquier punto de corte debe ser expresado como puntaje Z, que estandariza las mediciones de DMO por sexo y edad6,8. Arbitrariamente, se ha definido como osteopenia puntajes Z entre ¾1 y ¾2, mientras que osteoporosis puntajes Z £a -2.
La osteoporosis se puede clasificar en primaria, en la que existe un defecto genético en la estructura o ensamblaje de la matriz ósea; o secundaria, una complicación de una enfermedad crónica.
Enfrentamiento del niño con sospecha de osteoporosis
El diagnóstico de osteoporosis requiere de un alto índice de sospecha, ya que sus características clínicas pueden confundirse con los de la patología de base o ser exacerbados por el uso de fármacos, por lo que se debe ser muy exhaustivo en la anamnesis y examen físico del niño con sospecha de osteoporosis. Las formas de presentación más frecuente de un niño con osteoporosis son las fracturas frecuentes, hallazgo de osteopenia en una radiografía, dolores óseos con o sin alteración de la marcha, y lo que es más frecuente, la derivación para estudio y seguimiento de un niño con una enfermedad de riesgo. Es muy poco frecuente que una enfermedad crónica debute por la osteoporosis secundaria, a la excepción de la leucemia linfática aguda. La mayoría de las enfermedades endocrinológicas, a excepción del síndrome de Cushing o hipogonadismo, producen una disminución leve de la DMO. Así, la realización de estudios hormonales exhaustivos, en ausencia de clínica sugerente, es de bajo rendimiento. La osteoporosis que se presenta sin factores de riesgo evidentes en el niño, en la mayoría de los casos será de causa genética.
En la anamnesis es importante consignar antecedentes personales de patologías perinatales, fracturas en el neonato, peso y talla de nacimiento, ruptura prematura de membranas, aportes de nutrientes, especialmente calcio y vitamina D; enfermedades renales pulmonares, digestivas, nutricionales, neurológicas, hematológicas, reumatológicas, u otras; exposición solar, actividad física, antecedente de caídas y fracturas previas, tiempo de inmovilización, ingesta de fármacos (corticoides, anticonvulsivantes, quimioterapia). Dentro de los antecedentes familiares, las enfermedades genéticas, consanguinidad, deformidades óseas, fracturas recurrentes, litiasis urinaria, osteoporosis precoz y la talla de los padres. De la sintomatología actual, presencia de dolor óseo (especialmente de diáfisis extremidades inferiores y columna), deformidades, impotencia funcional (especialmente trastornos de la marcha), acortamiento de extremidades, disminución de la talla; y del examen fisíco el peso y la talla, segmentos corporales, buscar asimetrías, deformidades óseas, dismórfias, signos de raquitismo o carenciales. Evaluar la fontanela en el lactante, esmalte dentario y encías hiperlaxitud ligamentosa, articular o de piel, tanto en el lactante como en el niño mayor. En los pacientes púberes se debe evaluar también el desarrollo según Tanner y al examen neurológico observar especialmente atrofia muscular y reflejos osteotendíneos.
Los parámetros bioquímicos, permiten orientar hacia la patología de base, son inespecíficos y la mayoría de las veces son normales. Los niveles de calcio elevados y fosfato normales o bajos son sugerentes de hiperparatiroidismo; mientras que calcemia baja y fosfato normal o bajo orientan a raquitismo hipocalcémico. Estos valores deben corre-lacionarse con los de PTH. En patologías con alto recambio (tabla 1) aumentan los marcadores de recambio.
Tabla 1
Codiciones que disminuyen la formación ósea:
1. Fármacos (corticoides, ciclosporina)
2. Inmovilización proongada
3. Enfermedades hepáticas (colestacia crónica)
4. Intoxicación por aluminio (Nutrición prenteral)
5. Nutrición parenteral prolongada
Codiciones relacionadas con alto recambio óseo:
1. Corticoides
2. Inmovilización
3. Enfermedad de Paget
4. Hiperparatiroidismo primario y secundario
5. Raquitismo por déficit de vitamina-D o calcio
6. Osteoporosis asociada a síndrome de Kostmann y síndromes linfoproliferativos
La radiología convencional permite ver cambios con una pérdida
ósea mayor al 25%36. En grados severos de osteoporosis, la radiografía
de columna permite diagnosticar fracturas vertebrales, que pueden ser silentes,
los cuerpos vertebrales pueden adoptar una forma en cuña o bicóncava
(vértebras de pescado) (figura 2 a y b). En los huesos largos, la osteoporosis
se evidencia mejor en sus extremos, ya que son más ricos en hueso trabecular,
se observa pérdida de la trabéculas transversales y preservación
de las que están alineadas con los ejes de fuerza. Existe resorción
endosteal lo que lleva a un ensanchamiento del canal medular y adelgazamiento
cortical. Algunos hallazgos pueden orientar a patologías específicas
como en la osteogénesis imperfecta que muestra huesos largos finos y
curvos y hueso wormianos; y los defectos de mineralización en cartílagos
de crecimiento en raquitismo.
CAUSAS DE OSTEOPOROSIS EN EL NIÑO
Osteoporosis Primaria
Osteoporosis Juvenil Idiopática: se trata de una patología infrecuente que se presenta en un niño previamente sano y que se inicia en la etapa inmediatamente anterior al inicio puberal; ocasionalmente puede iniciarse antes de los 5 años. De comienzo insidioso, con síntomas inespecíficos que incluyen dolor óseo generalmente en la espalda, caderas y pies, con dificultad para deambular, baja de peso y fracturas de huesos largos, vértebras o metáfisis. Habitualmente se recupera espontáneamente dentro de 3 a 5 años, aunque algunos pacientes desarrollan deformidad progresiva. El diagnóstico es de exclusión. Su patogenia es desconocida, pero se plantea que podría ser debido a una anormal producción de matriz orgánica y a una disminución en la formación ósea.
Enfermedades del tejido conectivo: el prototipo de este grupo es la osteogénesis imperfecta, causada por una alteración en la matriz proteica, que lleva a una formación anómala del hueso con rápido recambio. Existen 4 tipos que varían desde la forma más severa y letal, hasta la forma leve, habitualmente subdiagnosticada. En el 80-90% de los casos se encuentra una mutación en el colágeno tipo I, pero en el resto se desconoce su causa. Se presenta como fracturas recurrentes después de traumatismos leves con o sin deformaciones óseas. Otras enfermedades de este grupo son los síndromes de Marfan y Ehlers-Danlos.
Síndromes genéticos y errores congénitos del metabolismo: se ha descrito un aumento en el riesgo de osteoporosis asociada a síndromes genéticos y enfermedades metabólicas, el origen es multifactorial debido a alteraciones intrínsecas de la estructura ósea, aumento del recambio, hipogonadismo, alteraciones en el metabolismo de vitamina D, efectos tóxicos de metabolitos y uso de fármacos. Entre las causas genéticas se encuentran síndrome de Turner, Down, Klinefelter, entre otros. Son causas metabólicas la fenilquetonuria, acidemia propiónica, galactosemia, Gaucher, aminoaciduria, enfermedad de Wilson y homocistinuria entre otros.
Osteoporosis Secundaria
Enfermedades Endocrinas:entre los factores hormonales que juegan un rol en la acumulación de masa ósea se encuentran la hormona de crecimiento (GH) y los factores insulinosímiles (IGF-I) que estimulan la proliferación y diferenciación de osteoblastos y síntesis de colágeno, llevando a un aumento en la formación ósea; participando además, en el metabolismo fosfo-cálcico. Los andrógenos suprarrenales y gonadales regulan distintos aspectos de la actividad osteoblástica (proliferación, diferenciación, mineralización y expresión génica), tienen también efecto anabólico y antiresortivo. Estrógenos y andrógenos actúan en el metabolismo fosfo-cálcico y en la hidroxilación de vitamina-D, contribuyendo a la acumulación de masa ósea durante la pubertad.
Por otro lado, las hormonas tiroideas son importantes reguladores del crecimiento normal y metabolismo óseo. Así, en pacientes deficientes en GH, hipogonádicos e hipertiroideos se produce una disminución en la DMO, que se recupera con el tratamiento sustitutivo. También se desarrolla osteoporosis en pacientes con síndrome de Cushing, ya que el aumento de esteroides endógenos aumenta la resorción, altera la formación ósea y disminuye la absorción intestinal de calcio y vitamina-D. La diabetes mellitus con mal control metabólico puede presentar osteopenia. Entre otras causas, se encuentra el hiperparatiroidismo, que en la edad pediátrica, generalmente es secundario a enfermedad renal.
Enfermedades nutricionales:todas aquellas patologías que involucran malabsorción o malnutrición pueden llevar a osteoporosis, entre ellas se encuentran: enfermedades gastrointestinales como enfermedad inflamatoria intestinal, enfermedad celíaca, enfermedad colestásica hepática; enfermedades respiratorias: fibrosis quísitca, síndrome de cilio inmóvil; y cada día más prevalente la anorexia nerviosa.
Enfermedades inmunológicas- inflamatorias:el desarrollo de la osteoporosis es multifactorial debido a la actividad inflamatoria, efecto de citoquinas en la resorción ósea, malnutrición, malabsorción, disminución en la ingesta de calcio, déficit de vitaminas y retraso puberal, a esto hay que sumar el efecto que producen los fármacos usualmente utilizados en estas patologías (glucocorticoides, metotrexate, inmunosupresores).
Fármacos: Existen múltiples fármacos que alteran la mineralización ósea, entre ellos los más importantes son los glucocorticoides, ya que son la causa más frecuente del desarrollo de osteoporosis; aproximadamente el 30 a 50% de los pacientes tratados crónicamente con glucocorticoides desarrolla osteoporosis. Dentro de los primeros 6 a 12 meses de terapia se produce la mayor pérdida de hueso trabecular, posteriormente la pérdida ósea es más lenta, pero sostenida. Los glucocorticoides actúan directamente sobre el hueso, e indirectamente alterando distintos ejes hormonales. No sólo se presenta con el uso de glucocorticoides por vía oral, sino que también se ha encontrado disminución de la DMO con dosis altas de corticoides inhalatorios, especialmente los de mayor absorción sistémica como la betametasona.
Neoplasias: a medida que la sobrevida aumenta se ha observado un incremento en el desarrollo de osteoporosis y fracturas patológicas. Esto se presenta con mayor frecuencia en las de origen linfático, especialmente la leucemia linfoblástica aguda, También se ha reportado en tumores sólidos y tumores cerebrales. El mecanismo, al igual que en otras patologías, es multifactorial (quimioterapia, altas dosis de glucocorticoides en forma crónica, malnutrición y disminución de la actividad física). La irradiación craneal es un importante predictor de disminución persistente de la DMO debido a hipopituitarismo.
Inmovilización: la actividad física es un factor muy importante en la determinación de la DMO. La reducción de la actividad física lleva a una disminución en las fuerzas mecánicas que estimulan la osteogénesis, a través de la contracción y fundamentalmente la gravedad enfermedades que causan inmovilización, como miopatías, neuropatías congénitas o adquiridas o parálisis cerebral se asocian al desarrollo de osteoporosis, a la inmovilización hay que sumar otros factores favorecedores, como son el tratamiento anticonvulsivante y alteraciones nutricionales.
Misceláneas: también se ha reportado osteoporosis en pacientes con hematopatías, como neutropenia congénita severa, anemia de Fanconi y Blackfan Diamon, talasemias, así como niños sometidos a transplante renal, hepático, cardíaco y de médula ósea.
El
mecanismo de producción de osteoporosis en enfermedades crónicas
es multifactorial, e incluye desnutrición, malabsorción de calcio,
déficit de vitamina-D, retraso puberal, discapacidades motoras o falta
de ejercicio, hipovitaminosis D por falta de exposición solar, tratamiento
con glucocorticoides u otros medicamentos y el efecto directo provocado por
los mediadores de inflamación.
Nuestra experiencia en la evaluación de pacientes con sospecha de osteopenia
se puede resumir en la tabla 2.
Tabla 2. "Etiología de osteoporosis en niños"
|
Patología |
nº
Pacientes |
nº(%) |
Osteoporosis |
| Enfermedad
reumatológica |
43 |
15 |
(34,8)
|
| Enfermedad
reumatológica |
43 |
15 |
(38,8)
|
| Corticoterapia |
38 |
17 |
(44) |
| Osteogénesis
Imperfecta |
25 |
25 |
(100) |
| Síndrome
de Kostmann |
9 |
5 |
(55,5) |
| Raquitismo
hipocalcémico |
4 |
3 |
(75) |
| Anorexia
nerviosa |
15 |
5 |
(33,3)
|
| Miopatía
neuropatía |
6 |
6 |
(100) |
| Errores
Congénitos del Metaboismo |
6 |
2 |
(33) |
| Osteoporosis
Juvenil Idiopática |
4 |
4 |
(100) |
| Otros |
3 |
3 |
(100) |
PREVENCIÓN
Las estrategias para prevenir la osteoporosis en niños y adolescentes se resumen en la tabla 3. En este punto es fundamental la rehabilitación adecuada de cada niño en particular, hecho que en nuestro medio por motivos de costos a veces se pospone. La promoción de estilos de vida saludable en pacientes con factores de riesgo de osteoporosis es fundamental.
TRATAMIENTO
En los grados leves de osteoporosis básicamente se deben intensificar las estrategias de prevención6(tabla 3). En nuestra experiencia, aproximadamente el 30% de estos pacientes presentan hipovitaminosis D, la que debe ser corregida antes de terapia antiresortiva, pues podría provocarse hipocalcemia. Se debe evitar el sobretratamiento controlando con niveles de calcio sérico y urinario (calciuria/creatininuria) y niveles séricos de 25OH D. El reemplazo de estrógeno, testosterona u hormona de crecimiento, cuando existe déficit, podría ser beneficioso, pero debe ser estudiado en cada caso.
Tabla 3. Estrategias de prevención de osteoporosis
En los casos severos el tratamiento con fármacos antiresortivos podría ser útil para lograr un aumento en la masa ósea. A pesar de que estos fármacos han sido validados en adultos, no existen estudios controlados que evalúen la eficacia y seguridad de estos medicamentos en niños, es por ello que los pacientes en que se sospeche el desarrollo de esta patología deben ser derivados al especialista y sólo se deben indicar bajo protocolos de investigación. Se ha sugerido tratar pacientes con fracturas vertebrales o DMO < a ¾2 DS, en descenso progresivo, y sin respuesta a las medidas convencionales29. De los fármacos antiresortivos, los que han mostrado mejores efectos en niños son los bifosfonatos, análogos sintéticos del pirofosfato. Su efecto antiresortivo esta dado por supresión de la actividad osteoclástica y apoptósis del osteoclasto; se ha reportado mejoría clínica y aumento de masa ósea en patologías como osteogénesis imperfecta, osteoporosis juvenil idiopática y parálisis cerebral. Se deben tener en consideración sus reacciones adversas entre las que se cuentan: osteopetrosis, defectos de mineralización (raquitismo-osteomalacia), nefrotoxicidad y teratogenicidad. Adicionalmente, no se conoce cuales pueden ser los efectos de un recambio óseo suprimido a largo plazo.
REFERENCIAS
1.- Lindsay R, Meunier PJ. Osteoporosis:review of the evidence for prevention, diagnosis and treatment and cost-effectiveness analysis. Osteoporos Int 1998; 8 (suppl 4): S1S88.
2.- Hansen MA, Overgaard K, Riis BJ, Christiansen C. Role of bone mass and bone loss in postmenopausal osteoporosis: 12 year study. Br Med J 1991; 303: 961-4.
3.- Cummings SR, Black DM, Nevitt MN et al.Bone density at various sites for prediction of hip fractures. Lancet 1993; 341: 72-5.
4.- Chan GM, Hess M, Hollis J, Book LS. Bone mineral status in chilhood accidental fractures. Am J Dis Child 1984; 138: 569-70.
5.- Goulding A, Jones IE, Taylor RW, Manning PJ, Williams SM. More broken bones: a 4-year double cohort study of young girls with and without distal forearm fractures. J Bone Miner Res 2000; 15: 2011-8.
6.- Saggese G, Baroncelli GI, Bertelloni S.Osteoporosis in children and adolescents: diagnosis, risk factors, and prevention. J Pediatr Endocrinol Metab 2001; 14: 833-59.
7.- Baron R.Anatomy and ultraestructure of bone. En: Primer on the matabolic bone diseases and disorders of mineral metabolism.Favus MJ.4th Ed. Philadelphia: Lippincott Williams & Wilkins 1999; 3-10.
8.- Van der Sluis IM, de Muinck Keizer-Schrama S.Osteoporosis in chilhood: bone density of children in health an disease. J Pediatr Endocrinol Metab 2001; 14: 817-32.
9.- Mundy GR. Bone remodeling. En: Favus MJ. Primer on the metabolic bone diseases and disorders of mineral metabolism. 4th Ed. 1999: 30-7.
10.- Recker R, Barger-Lux J.Embriology, anatomy, and microstructure of bone. En: Coe F, Favus M. eds. Disorders of bone and mineral metabolism. 2th Ed.Philadelphia:Lippincott Williams & Wilkins 2002; 177-97.
11.- Boyan B, Schwartz Z, Howell D et al.Biology, chemistry, and biochemistry of the mammalian growth plate. En: Coe F, Favus M.eds. Disorders of bone and mineral metabolism. 2 th Ed. Philadelphia: Lippincott Williams & Wilkins 2002; 255-314.
12.- Dempster D. Bone remodeling. En: Coe F, Favus M.eds. Disorders of bone and mineral metabolism. 2th Ed. Philadelphia: Lippincott Williams & Wilkins 2002; 315-43.
13.- Mckay Ch, specker B, Chesney R. Bone and mineral metabolism during chilhood. En: Coe F, Favus M. eds. Disorders of bone and mineral metabolism. 2 th Ed. Philadelphia: Lippincott Williams & Wilkins 2002; 360-80.
14.- Gertner M. Chilhood and adolescence. En:Favus MJ. Primer on the metabolic bone diseases and disorders of mineral metabolism. 4th Ed. 1999; 45-9.
15.- Theintz G, Buchs B, Rizzoli R et al. Longitudinal monitoring of bone mass accumulation in heaalth adolescents: evidence for a marked reduction after 16 years of age at the levels of lumbar spine and femoral neck in female subjects. J Clin Endocrinol Metab 1992; 75: 1060-5.
16.- Matkovic V, Jelic T, Wardlaw GM et al.Timing of peak bone mass in caucasian females and its implication for the prevention of osteoporosis. Interference from a cross-sectinal model. J Clin Invest 1994; 93: 799-808.
17.- Soyka LA, Fairfield WP, Klibanski A. Hormonal determinants and disorders of peak bone mass in children. J Clin Endocrinol Metab 2001; 85: 3951-63.
18.- Audi L, García-Ramírez M, Carrascosa A.Genetic determinants of bone mass. Horm Res 1999; 51: 105-23.
19.- Pocock NA, Eisman JA, hopper JL, Yeates MG, Sambrook PN, Eberl S.Genetic determinants of bone mass in adults. J Clin Invest 1987; 80: 706-10.
20.- Fuchs RK, Bauer JJ, Snow CM.Jumping improves hip and lumbar spine bone mass in prepubescent children: a randomissed controlled trial. J Bone Miner Res 2001; 16: 148-56.
21.- Nguyen Tv, Livshits G, Center JR, Yakovenko K, Eisman JA.Genetic determination of bone mineral density: evidence for a major gene. J Clin Endocrino Metab 2003; 88 (8): 3614-20.
22.- Lopez JM. Utilidad de los marcadores bioquímicos del recambio óseo en osteoporosis. Boletín Esc. De Medicina P. Universidad Católica de Chile 1999; 28: 19-23.
23.- Khosla S, Kleerekoper M. Biochemical markers of bone turnover. En: Favus MJ. Primer on the metabolic bone diseases and disorders of mineral metabolism. 4th Ed. 1999: 128-34.
24.- Epstein S. Serum and urinary markers of bone remodeling:assesment of bone turnover. Endocr Rev 1988; 9: 437-45.
25.- Tobiume H, Kanzaki S, Hida S et al.Serum bone alkaline phosphatase isoenzyme levels in normal children and children with growth hormone (GH) deficiency: a potential marker for bone formation and response to GH therapy. J Clin Endocrinol Metab 1997; 82: 2056-61.
26.- Calvo MS, Eyre DR, Gundberg CM.Molecular basis and clinical application of biological markers of bone turnover. Endocr Rev 1996; 17: 333-68.
27.- Clemens JD, Herrick MV, Singer FR, Eyre DR.Evidence that serum NTx(collagen-type I N-telopeptides) can act as an inmunochemical marker of bone resorption. Clin Chem 1997; 43: 2058-63.
28.- Sartoris DJ, Resnick D.Dual-energy radiographic absortiometry for bone densitometry: current status and perspective. Am J Roentgenol 1989; 152: 241-6.
29.- Steelman J, Zeitler P.Pediatric osteoporosis. International Symposium on A Current Review of Pediatric Endocrinoloy. Montreal, Quebec, Canadá 2001; 99-107.
30.- Kroger HPG, Vainio P, Nieminen J, Kotaniemi A. Comparison of different models for interpreting bone mineral density measurements using DEXA and MRI technology. Bone 1995; 17: 157-9.
31.- Schonau E. Review: Problems of bone analysis in chilhood and adolescence. Pediatr Nephrol 1998; 12: 420-9.
32.- Fuerst T, Gluer CC, Genant HK. Quantitative ultrasound. Eur J Radiol 1995; 20:188-92.
33.- Kanis JA, Melton LJ, Christiansen C, Johnston CC, Khaltaev N. The diagnosis of osteoporosis. J Bone Miner Res 1994; 9: 1137-4
34.- Cassidy JT.Osteopenia and osteoporosis in children. Clin Exp Rheumatol 1999; 17: 245-50.
35.- Klein GL. Osteoporosis. www.emedicine.com.
36.- Campusano C.Enfrentamiento clínico del paciente con osteoporosis. Boletín Esc. De Medicina P. Universidad Católica de Chile 1999; 28: 24-30.
37.- Whyte M.Osteogenesis imperfecta.En: Favus MJ. Primer on the metabolic bone diseases and disorders of mineral metabolism. 4th Ed. 1999; 386-8.
38.- Reyes ML.Raquitismo. En Beas Francisco. Endocrinología del niño y el adolescente. 2° Ed. Mediterráneo 2002; 295-306.
39.- Norman M.Juvenile osteoporosis. En: Favus MJ. Primer on the metabolic bone diseases and disorders of mineral metabolism. 4th Ed. 1999; 302-4.
40.- Rauch F, Travers R, Norman ME, Taylor A,Parfitt AM, Glorieux F. Deficient bone formation in idiopathic juvenile osteoporosis: a histomorphometric study of cancellous iliac bone. J Bone Miner Res 2000; 15: 957-63.
41.- Saggese G, Baroncelli GI, Federico G, Bertelloni S.Effects of growth hormone on phosphocalcium homeostasis and bone metabolism. Horm Res 1995; 44 (suppl 3): 55-63.
42.- Ohlsson C, Bengtsson B-A, Isaksson OGP, Andreassen TT, Slootweg MC.Growth hormone and bone. Endocr Rev 1998;19: 55-79.
43.- Finkelstein JS, Neer RM, Biller BMK, Crawford JD, Klibanski A.Osteopenia in men with a history of delayed puberty. N Engl J Med 1992; 326: 600-4.
44.- Miller KK, Klibanski A.Amenorrheic bone loss. J Clin Endocrinol Metab 1999; 84: 1117-783.
45.- Lucidarme N, Ruiz JC, Czernichow P, Leger J. Reduced bone mineral density at diagnosis and bone mineral recovery during treatment in children with Grave’s disease. J Pediatr 2000; 137: 56-62.
46.- Mora S, Weber G, Marenzi K, et al.Longitudinal changes of bone density and bone resorption in hyperthyroid girls during treatment. J Bone Miner Res 1999; 14: 1971-7.
47.- Rabinovich CE. Bone mineral status in juvenile rheumatoid arthritis. J Rheumatol 2000; 27: 34-7.
48.- Reid I.Editorial: Glucocorticoid effects on bone. J Clin Endocrinol Metab 1998; 83 (6): 1860-2.
49.- Mul D, van suijlekom-smith LWA, ten Cate R, Bekkering WP, Muinck Keizer-Schrama SMPF.Bone mineral density and body composition and influencing factors in children with rheumatic diseases treated with corticosteroids. J Pediatr Endocrinol Metab 2002; 15: 187-92.
50.- Covar R, Leung D, McCormick D, Steelman J, Zeitler P, Spahn J. Risk factors associated with glucocorticoid-induced adverse effects in children with severe asthma. J Allergy Clin Inmunol 2000; 106: 651-9.
51.- Reid I, Heap S. determinants of vertebral mineral density in patients receiving long-term glucocorticoid therapy. Arch Intern Med 1990; 150: 2545-8.
52.- Ledford D, Apter A, Brenner AM et al. Osteoporosis in the corticosteroid-treated patient with asthma. J Allergy Clin Inmunol 1998; 102: 353-62.
53.- Shaw NJ, White CP, Fraser WD, Rosenbloom L. Osteopenia in cerebral palsy. Arch Dis Child 1994; 71: 235-8.
54.- Dauty M, Perrouin Verbe B, Maugars Y, Dubois C, Marthe JF.Supralesion and sublesional bone mineral density in spinal cord-injured patients. Bone 2000; 27: 305-9.
55.- Nishiyama S, Kuwahara T, Matsuda I.Decreased bone density in severely handicapped children and adults, with reference to influence of limited mobility and anticonvulsivant medication. Eur J Pediatr 1986; 144: 457-63.
56.- Tannirandon P, Epstein S.Drug-Induced Bone loss. Osteoporosis Int 2000; 11: 637-59.
57.- Hesseling PB, Hough SF, Nel ED, van riet FA, Beneke T, Wessels G.Bone mineral density in log-term survivors of chilhood cancer. Int J Cancer 1998; 11 (suppl): 44-7.
58.- Vassilopoulou-Sellin R, Brosnan P, Delpassand A, Zietz H, Klein MJ, Jaffe N. Osteopenia in young adult survivors of chilhood cancer. Med Pediatr Oncol 1999; 32: 272-8.
59.- Boot AM, Van der Heuvel-Eibrink MM, Hahlen K, Krenning EP, de Muink Keizer-Schrama SMPF.Bone mineral density in acute lymphoblastic leukaemia. Eur J Cancer 1999; 35: 1693-7.
60.- Bishop NJ, Williams DM, Compston JC, Stirling DM, Prentice A. Osteoporosis in severe congenital neutropenia treated with granulocyte colony-stimulating factor. Br J Hematol 1995; 89: 927-8.
61.- Yakisan E, Chirg E, Zeidler C et al. High incidence of significant bone loss in patients with severe congenital neutropenia (Kostmann’s syndrome) J Pediatr 1997; 131: 592-7.
62.- Marini J. Do Biphosphonates make children’s bones better or brittle. N Engl J Med 2003; 349 (5): 423-6.
63.- Whyte M, Wenkert D, Clements K, McAlister W, Mumm S.Biphosphonate-Induced Osteopetrosis. N Engl J Med 2003; 349 (5): 457-63.